Ácido y base |
Cuando en una solución la concentración de iones hidrógeno (H+)es mayor que la de iones hidróxilo (OH – ), se dice que es ácida . En cambio, se llama básica o alcalina a la solución cuya concentración de iones hidrógeno es menor que la de iones hidróxilo.
Una solución es neutra cuando su concentración de iones hidrógeno es igual a la de iones hidróxilo. El agua pura es neutra porque en ella [H + ] = [OH – ]. (Ver: Ionización del agua )
La primera definición de ácido y base fue acuñada en la década de 1880 por Svante Arrhenius quien los define como sustancias que pueden donar protones (H + ) o iones hidróxido (OH - ), respectivamente. Esta definición es por supuesto incompleta, pues existen moléculas como el amoniaco (NH 3 ) que carecen del grupo OH - y poseen características básicas.

|
Una definición más general fue propuesta en 1923 por Johannes Brönsted y Thomas Lowry quienes enunciaron que una sustancia ácida es aquella que puede donar H + , exactamente igual a la definición de Arrhenius; pero a diferencia de éste, definieron a una base como una sustancia que puede aceptar protones.
Una definición más general sobre ácidos y bases fue propuesta por Gilbert Lewis quien describió que un ácido es una sustancia que puede aceptar un par de electrones y una base es aquella que puede donar ese par.
Ver: ¿Qué es el pH?
Los ácidos y las bases se caracterizan por:
|
Ácidos
|
Bases
|
| Tienen sabor agrio (limón, vinagre, etc). | Tiene sabor cáustico o amargo (a lejía) |
| En disolución acuosa enrojecen la tintura o papel de tornasol | En disolución acuosa azulean el papel o tintura de tornasol |
| Decoloran la fenolftaleína enrojecida por las bases | Enrojecen la disolución alcohólica de la fenolftaleína |
| Producen efervescencia con el carbonato de calcio (mármol) | Producen una sensación untuosa al tacto |
| Reaccionan con algunos metales (como el cinc, hierro,…), desprendiendo hidrógeno | Precipitan sustancias disueltas por ácidos |
| Neutralizan la acción de las bases | Neutralizan la acción de los ácidos |
| En disolución acuosa dejan pasar la corriente eléctrica, experimentando ellos, al mismo tiempo una descomposición química | En disolución acuosa dejan pasar la corriente eléctrica, experimentando ellas, al mismo tiempo, una descomposición química |
| Concentrados destruyen los tejidos biológicos vivos (son corrosivos para la piel) | Suaves al tacto pero corrosivos con la piel (destruyen los tejidos vivos) |
| Enrojecen ciertos colorantes vegetales | Dan color azul a ciertos colorantes vegetales |
| Disuelven sustancias | Disuelven grasas y el azufre |
| Pierden sus propiedades al reaccionar con bases | Pierden sus propiedades al reaccionar con ácidos |
| Se usan en la fabricación de jabones a partir de grasas y aceites |
Tanto ácidos como bases se encuentran en gran cantidad en productos usados en la vida cotidiana, para la industria y la higiene, así como en frutas y otros alimentos, mientras que el exceso o defecto de sus cantidades relativas en nuestro organismo se traduce en problemas de salud.
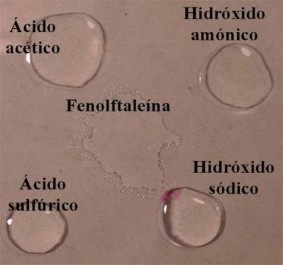
|
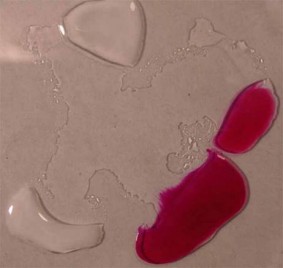
|
| Cómo reacciona una gota de fenolftaleína al unirse con ácidos o con bases. |
Teoría Ácido-Base de Lowry-Bronsted
Según Bronsted y Lowry, ácidos son todos los compuestos o iones capaces de ceder protones (H + ) al medio y bases son los que pueden aceptar protones del medio.
Cuando una molécula o anión puede tomar un H + (base de Bronsted-Lowry), se forma su "ácido conjugado"
|
Base |
Protón que gana |
Ácido conjugado |
|
OH - |
H + |
H 2 O |
|
NH 3 |
H + |
NH 4 + |
|
CO 3 -2 |
H + |
CO 3 H - |
Cuando un ácido pierde un ion hidrógeno, se forma su "base conjugada".
|
Ácido |
Protón que pierde |
Base conjugada |
|
ClH |
H + |
Cl - |
|
SO 4 H 2 |
H + |
SO 4 H - |
|
NO 3 H |
H + |
NO 3 - |
Fuerza de los ácidos y las bases
La fuerza de un ácido o la de una base está determinada por su tendencia a perder o a ganar protones. Los ácidos pueden dividirse en fuertes (ClH, SO 4 H 2 , NO 3 H, etc.) y débiles (PO 4 H 2 – , CH 3 COOH, CO 3 H 2 , etc.). Las moléculas de los primeros se disocian en forma prácticamente total al ser disueltos en agua. Los segundos sólo ionizan una pequeña proporción de sus moléculas. De aquí que, para una misma concentración de ácido, la concentración de iones hidrógeno es mayor en las soluciones de ácidos fuertes que en las de los débiles.
Las bases también pueden dividirse en fuertes (NaOH, KOH, Ca (OH) 2 , etc.) y débiles (NH 3 , trimetilamina, anilina, etc.). Las primeras se disocian completamente en solución. Al igual que para ácidos débiles, las constantes de disociación de las bases débiles (K B ) reflejan el grado de ionización.
Una generalización útil acerca de las fuerzas relativas de los pares ácido-base es que si un ácido es fuerte, su base conjugada es débil y, para las bases, si una sustancia es una base fuerte, su ácido conjugado es débil.
Fuentes Internet:
http://fresno.cnice.mecd.es/fgutie6/quimica2/ArchivosHTML/Teo_4_princ.htm
http://es.wikibooks.org/wiki/Qu%C3%ADmica_/_Definici%C3%B3n_%C3%A1cido-base

