Ionización y equilibrio iónico del agua |
Equilibrio iónico del agua
El agua pura es un electrolito débil que se disocia en muy baja proporción en sus iones hidronio o hidrógeno H 3 O + (también escrito como H + ) e hidróxido o hidróxilo OH – .
De todos modos, dos moléculas polares de agua pueden ionizarse debido a las fuerzas de atracción por puentes de hidrógeno que se establecen entre ellas.
Aunque lo haga en baja proporción, esta disociación del agua en iones, llamada ionización , se representa según la siguiente ecuación
![]()
La cual, resumiendo un poco queda como
![]()
O, más resumida aún, queda como
![]()
Al producto de la concentración de iones hidroxonio o hidronio (H 3 O + ) por la concentración de iones hidróxido o hidroxilo (OH − ) se le denomina producto iónico del agua y se representa como K w . Las concentraciones de los iones H + y OH – se expresan en moles / litro (molaridad) .
Este producto tiene un valor constante igual a 10 −14 a 25º C, como se grafica en la siguiente ecuación
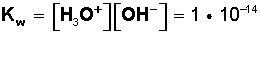
O, que es lo mismo:
![]()
Debido a que en el agua pura por cada ion hidronio (o ion hidrógeno) hay un ion hidróxido (o hidroxilo), la concentración es la misma, por lo que:
![]()
De esta expresión se deduce que las concentraciones de hidronios (también llamada de protones) (H+) y de hidroxilos (OH-) son inversamente proporcionales ; es decir, para que el valor de la constante de disociación se mantenga como tal, el aumento de una de las concentraciones implica la disminución de la otra.
PSU: Química, Pregunta 12_2005
Ionización del agua y el Ph
El agua no es un líquido químicamente puro, ya que se trata de una solución iónica que siempre contiene algunos iones H 3 O + y OH –.
(Ya vimos que se utiliza el símbolo H + , en lugar de H 3 O + ).
También ya mostramos el producto [H+]•[OH-]= 10 –14 , que se denomina producto iónico del agua . Pues bien, ese valor constituye la base para establecer la escala de pH , que mide la acidez o alcalinidad de una disolución acuosa; es decir, su concentración de iones [H + ] o [OH – ], respectivamente.
Recapitulemos sobre el pH
Repitamos el concepto: el pH es una medida de la acidez o alcalinidad de una solución . Lo que el pH indica exactamente es la concentración de iones hidronio (o iones hidrógeno) — [H3O+] o solo [H+]— presentes en determinadas sustancias.
La sigla pH significa "potencial de hidrógeno" ( p ondus H ydrogenii o p otentia H ydrogenii; del latín pondus , = peso; potentia , = potencia; hydrogenium , = hidrógeno). Este término fue acuñado por el químico danés Sorensen, quien lo definió como el logaritmo negativo de base 10 de la actividad de los iones hidrógeno.
Desde entonces, el término "pH" se ha utilizado universalmente por lo práctico que resulta para evitar el manejo de cifras largas y complejas. En disoluciones diluidas, en lugar de utilizar la actividad del ion hidrógeno, se le puede aproximar empleando la concentración molar del ion hidrógeno.
Por ejemplo, una concentración de [H 3 O + ] = 1 × 10 –7 M (0,0000001) es simplemente un pH de 7 ya que: pH = –log[10 –7 ] = 7.
El pH típicamente va de 0 a 14 en disolución acuosa, siendo ácidas las disoluciones con pH menores a 7 (el valor del exponente de la concentración es mayor, porque hay más protones en la disolución), y alcalinas las que tienen pH mayores a 7. El pH = 7 indica la neutralidad de la disolución (donde el disolvente es agua).
En la figura de abajo se señala el pH de algunas soluciones. En general hay que decir que la vida se desarrolla a valores de pH próximos a la neutralidad.
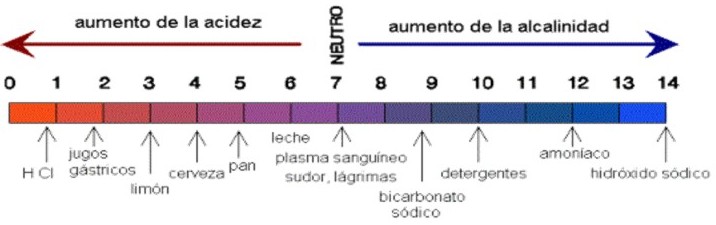
Los organismos vivos no soportan variaciones del pH mayores de unas décimas de unidad y por eso han desarrollado a lo largo de la evolución mecanismos que mantienen el pH constante.
Ver: Soluciones (o disoluciones) químicas
Fuente Internet:
www.itescam.edu.mx/principal/sylabus/fpdb/.../r16198.DOC

