Cambios químicos en la materia |
En la naturaleza y en la vida diaria, nos encontramos constantemente con fenómenos físicos y con fenómenos químicos .

|
|
El mejor ejemplo de cambio químico: combustión.
|
Fenómeno físico es aquel que ocurre sin que haya transformación de la materia involucrada. En otras palabras, cuando se conserva la sustancia original. Ejemplos: cualquiera de los cambios de estado de la materia y también acciones como patear una pelota, romper una hoja de papel.
En todos los casos, encontraremos que hasta podría cambiar la forma, como cuando rompemos el papel, pero la sustancia se conserva, seguimos teniendo papel. (Ver: Cambios físicos de la materia ).
Fenómeno químico es aquél que, al ocurrir, tiene como resultado una transformación de materia. En otras palabras, cuando no se conserva la sustancia original. Ejemplos: cuando quemamos un papel, cuando respiramos, y en cualquier reacción química . En todos los casos, encontraremos que las sustancias originales han cambiado, puesto que en estos fenómenos es imposible conservarlas.
Para entender claramente la diferencia entre fenómeno físico y fenómeno químico veremos lo que ocurre en un proceso natural como la fotosíntesis .
|
Durante el proceso de fotosíntesis |
Fenómeno |
|
a- la hoja toma CO 2 del aire (también llega el H 2 O tomada del suelo por la raíz) |
Físico |
|
b- el agua se transforma en Hidrógeno y Oxígeno, |
Químico |
|
c- el Oxígeno se desprende de la planta y vuelve a la atmósfera |
Físico |
|
d- el Hidrógeno reacciona con el Dióxido de Carbono para formar Almidón. |
Químico |
Ahora veamos qué ocurre en el motor de un auto cuando está en movimiento.
|
En un auto |
Fenómeno |
|
a- se inyecta gasolina en un carburador, |
Físico |
|
b- se mezcla con aire, |
Físico |
|
c- la mezcla se convierte en vapor, |
Físico |
|
d- se quema ( y los productos de la combustión ) |
Químico |
|
e- se expanden en el cilindro |
Físico |
Reacciones químicas

|
|
Un clavo se oxida con el aire: reacción química.
|
Por experiencia, sabemos que un trozo de hierro se oxidará si lo dejamos a la intemperie, y lo sabemos aunque no poseamos conocimientos de química.
Lo que ocurre es una reacción química en la cual el hierro se combina con el oxígeno presente en el aire para formar una sustancia distinta a las originales, un óxido de hierro.
El origen de una nueva sustancia, como el óxido de hierro en nuestro ejemplo, significa que ha ocurrido un reordenamiento de los electrones dentro de los átomos, y se han creado nuevos enlaces químicos. Estos enlaces químicos determinarán las propiedades de la nueva sustancia.
La mayoría de los cambios químicos son irreversibles. Al quemar un trozo de madera ya no podremos volver a obtenerlo a partir de las sustancias en que se ha convertido: cenizas y gases.
Ver: PSU: Pregunta 01_2005(Química2)
Sin embargo, hay otros cambios químicos en que la adición de otra sustancia provoca la obtención de la sustancia original y en ese caso se trata de un cambio químico reversible. Así, pues, para producir un cambio químico reversible hay que provocar otro cambio químico.
Todo cambio químico involucra una reacción entre diferentes sustancias produciendo la formación de sustancias nuevas.
Entonces, una reacción química es un proceso en que una o más sustancias se transforman en otra u otras sustancias de diferente naturaleza.
Las reacciones químicas se manifiestan en alguna de estas formas:
• emisión de gases
• efervescencia
• cambios de color
• emisión de luz
• elevación de la temperatura
• formación de nuevas sustancias.
|
|
Manifestaciones de una reacción química.
|
La respiración de los animales y la digestión de los alimentos constituyen ejemplos importantes de reacciones químicas; por eso se dice que el cuerpo humano es como un laboratorio químico.
El estudio metódico de las reacciones químicas ha permitido a los científicos transformar los productos naturales y obtener toda clase de sustancias, tales como: fibras sintéticas, plásticos, insecticidas y detergentes, todo ello tan útil en nuestra vida diaria.
Tipos de reacciones químicas
Es necesario reconocer, que una reacción química sólo puede corresponder a un fenómeno químico que se verifique en condiciones adecuadas; es decir, no se debe proponer una reacción química inventada o que no sea una reacción real. Sin embargo, no siempre es posible predecir sí, al poner en contacto ciertas sustancias, se llevará a cabo la reacción o cuales serán los productos.
Ahora bien, en miles de experimentos realizados en el mundo, debidamente repetidos y controlados en el laboratorio, las reacciones químicas se pueden clasificar en los siguientes tipos:
De síntesis o combinación
Es un fenómeno químico, y a partir de dos o más sustancias se puede obtener otra (u otras) con propiedades diferentes. Para que tenga lugar, debemos agregar las sustancias a combinar en cantidades perfectamente definidas, y para producirse efectivamente la combinación se necesitará liberar o absorber calor (intercambio de energía).
La combinación del hidrógeno y el oxígeno para producir agua y la del hidrógeno y nitrógeno para producir amoníaco son ejemplos
2H 2 + O 2 —› 2 H 2 O formación de agua
3 H 2 + N 2 —› 2 N H 3 formación de amoníaco
De descomposición
Es un fenómeno químico, y a partir de una sustancia compuesta (formada por dos o más átomos), puedo obtener dos o más sustancias con diferentes propiedades.
Ejemplos: al calentar óxido de mercurio, puedo obtener oxígeno y mercurio; se puede hacer reaccionar el dicromato de amonio para obtener nitrógeno, óxido crómico y agua.
Para que se produzca una combinación o una descomposición es fundamental que en el transcurso de las mismas se libere o absorba energía, ya que sino, ninguna de ellas se producirá. Al final de cualquiera de las dos tendremos sustancias distintas a las originales. Y ha de observarse que no todas las sustancias pueden combinarse entre sí, ni todas pueden ser descompuestas en otras.
De sustitución o de reemplazo
En este caso un elemento sustituye a otro en un compuesto, ejemplos:
Zn + 2HCl ——› ZnCl 2 + H 2
Mg + H 2 SO 4 ——› Mg SO 4 + H 2
De doble sustitución o de intercambio
En este tipo de reacciones se intercambian los patrones de cada compuestos, ejemplo
2 CuOH + H 2 SO 4 ——› Cu 2 SO 4 + 2H 2 O
3BaCl 2 (ac) + Fe 2 (SO 4 ) 3 (ac) ——› 3BaSO 4 + 2FeCl 2 (ac)

|
|
Agua: reacción química de síntesis.
|
Reactantes y productos
Para entenderlas y analizarlas, las reacciones químicas se representan, como ya vimos en los ejemplos anteriores, mediante ecuaciones químicas .
Una ecuación química es la representación escrita de una reacción química. En toda reacción química debemos distinguir los reactantes y los productos .
Los reactantes son sustancias que al combinarse entre ellas a través de un proceso llamado reacción química forman otras sustancias diferentes conocidas como productos de la reacción. (Ver: Velocidad de una reacción química )
En una ecuación química, los reactantes y productos se escriben, respectivamente, a la izquierda y a la derecha, separados mediante una flecha. El sentido de la flecha indica el transcurso de la reacción y debe leerse como: da origen a
Reactantes ——› dan origen a Productos
Tomaremos como ejemplo el agua, las sustancias reactantes son el hidrógeno (cuya fórmula es H 2 ) y el oxigeno (cuya fórmula es O 2 ), al combinarlas se produce una reacción química y obtenemos como producto el agua:
Dos moléculas de hidrógeno (2H 2 ) reaccionan con una molécula de oxigeno (O 2 ) para formar dos moléculas de agua (2H 2 O).
Reacción química aeróbica:
Es un proceso que requiere de la presencia del oxígeno para llevar a cabo la producción de energía.
Reacción química anaeróbica:
Es un proceso que a diferencia del aeróbico, se lleva a cabo en ausencia de oxígeno.
Cuando hacemos ejercicio aeróbico (correr, nadar por tiempo prolongado, etc.) la energía la obtenemos por medio del oxígeno que respiramos. El oxígeno llega a las fibras musculares a través de la sangre, donde se produce una serie de reacciones químicas con los nutrientes que nos entregan los alimentos, produciéndose la energía.
Cuando hacemos ejercicio anaeróbico (saltos, levantar pesas, carreras cortas y rápidas, etc.) necesitamos energía en un corto periodo de tiempo, y esta la obtenemos por medio de los hidratos de carbono y las grasas, que al descomponerse químicamente suministran la energía anaeróbica, llamada de esta manera porque toda esta reacción química se produce sin la presencia de oxígeno.
Ver: Estequiometría
|
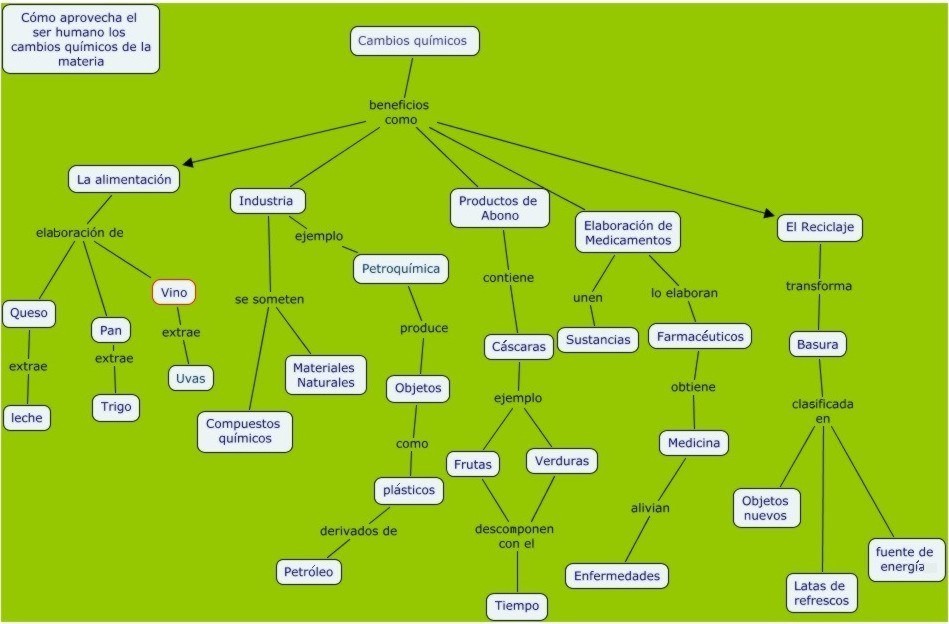
Mapa conceptual: Reacciones químicas aprovechadas por el hombre |
|
Fuentes Internet:
http://www.fortunecity.com/campus/dawson/196/reacquim.htm
http://www.anit.es/enbor/eqquim.html
http://orbita.starmedia.com/~zitro57/equilibrio.html
www.miexamen.com/Reacciones%20quimicas.htm
Mapa conceptual sobre los usos que da en hombre a los cambios químicos, tomado de:

