Concepto de Oxidación |
Expresado de una manera muy general, diremos que la oxidación ocurre cuando un átomo inestable pierde un electrón, lo que permite que el átomo forme un compuesto nuevo con otro elemento.
Básicamente existen dos tipos de reacciones químicas:
1) Aquellas en las cuales reaccionan iones o moléculas sin cambio aparente de la estructura electrónica de las partículas, y
2) Reacciones en las cuales los iones o átomos experimentan cambios de estructura electrónica.

|
| Casco metálico oxidado. |
En el segundo tipo de reacción puede haber transferencia real de electrones de una partícula a otra o la forma en que se compartan los electrones puede modificarse. Este último tipo de reacción que involucra cambios electrónicos se llama reacción de oxidación-reducción .
Oxidación
Originalmente, el término oxidación se asignó a la combinación del oxígeno con otros elementos. Existían muchos ejemplos conocidos de esto. El hierro se enmohece y el carbón arde. En el enmohecimiento, el oxígeno se combina lentamente con el hierro formando óxido ferroso (Fe 2 O 3 ); en la combustión, se combina rápidamente con el carbón para formar CO 2 . La observación de estas reacciones originó los términos oxidación “lenta” y "rápida” .
Sin embargo, los químicos observaron que otros elementos no metálicos se combinaban con las sustancias de la misma manera que lo hacia el oxígeno con dichas sustancias. El oxígeno, el antimonio y el sodio arden en atmósfera de cloro y el hierro en presencia de flúor. Como estas reacciones eran semejantes, los químicos dieron una definición de oxidación más general. Los reactantes O 2 o Cl 2 , eliminaban electrones de cada elemento. Por tanto, la o xidación se definió como el proceso mediante el cual hay pérdida aparente de electrones de un átomo o ión . (Ver: PSU: Química, Pregunta 02_2005 )
Reducción
Originalmente una reacción de reducción se limitaba al tipo de reacción en la cual los óxidos se “reducían" (se desprendían) de sus óxidos. El óxido de hierro se "reducía” a hierro con monóxido de carbono. El óxido de cobre (II) podía “reducirse” a cobre con hidrógeno. En estas reacciones se eliminaba oxígeno y se obtenía el elemento libre. El elemento libre puede obtenerse de otras maneras. La inmersión de un clavo de hierro en una solución de sulfato de cobre (II) causa una reacción en la cual se produce cobre libre.
La semejanza entre las reacciones de oxidación-reducción condujo a los químicos a formular una definición más general de reducción: La reducción es un proceso mediante el cual los átomos o iones adquieren electrones.
Agentes oxidantes y reductores

|
| Alimentos al vacío, protegidos de la oxidación |
En una reacción de oxidación-reducción hay transferencia de electrones. Todos los electrones intercambiados durante una reacción deben tomarse en cuenta. Por tanto, parece razonable que la oxidación y la reducción ocurran simultáneamente en una reacción: se pierden y se ganan electrones al mismo tiempo. De otro modo, los electrones (electricidad) serían almacenados en los productos. No existe evidencia de tal almacenaje de electrones.
La sustancia que en la reacción suministra electrones es el agente reductor. El agente reductor contiene los átomos que se oxidan (los átomos que pierden electrones). La sustancia que en la reacción gana electrones es el agente oxidante. Este contiene los átomos que se reducen (los átomos que ganan electrones).
Si una sustancia suministra fácilmente electrones se dice que es un agente reductor fuerte. Sin embargo, su forma oxidada normalmente es un agente oxidante débil. Si una sustancia gana electrones con facilidad, se dice que es un agente oxidante fuerte. Su forma reducida es un agente reductor débil.
Número de oxidación o estado de oxidación
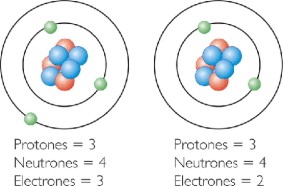
¿Cómo puede determinarse que se ha efectuado una reacción de oxidación-reducción? Esto se logra detectando cualquier desplazamiento electrónico ocurrido durante la reacción. Para indicar los cambios electrónicos, se utiliza el número de oxidación de los átomos de la reacción. El número de oxidación es la carga aparente de un átomo cuando se asigna un cierto número de electrones a determinados átomos o iones. El cambio de los números de oxidación durante una reacción indica la realización de una reacción de oxidación-reducción.
Por ejemplo, supóngase que el hierro, como reactante tiene un número de oxidación de +2. Si el hierro aparece como producto con un número de oxidación diferente de +2 por ejemplo, +3 ó 0, se ha efectuado una reacción redox (óxido-reducción).
|
| El número de oxidación se define como: El número de electrones que un elemento puede ganar o perder cuando se combina con los átomos de otro elemento. |
Este número de oxidación depende en principio de la posición que tienen los elementos en la tabla periódica y del hecho que presentan los elementos de adquirir la estructura atómica de los gases nobles, es decir el tener ocho electrones en su último nivel de energía
Una de las reglas empíricas fundamentales de la química es que un átomo que contiene ocho electrones en su nivel más externo es particularmente estable. Esta regla se llama regla del octeto. Aunque el átomo de helio tiene únicamente dos electrones en su nivel más externo, también es uno de los elementos excepcionalmente estables. Su nivel más externo también es el primer nivel y sólo acomoda un par de electrones. Por tanto, su nivel más externo está completamente lleno. De manera que se considerara que la regla del octeto incluye al helio.
Tipos de Oxidación
Por lo general, el término oxidación se aplica a procesos cuyas manifestaciones son lentas ( oxidación lenta ) y en donde la energía que se produce (siempre energía química) no se percibe porque se disipa en el ambiente, por ejemplo, son fenómenos de oxidación lenta: la respiración, la corrosión de los metales, la putrefacción de la madera , etcétera.
En las oxidaciones rápidas los efectos son inmediatos, claramente visibles, generan grandes cantidades de calor y en ellas, debido a la elevación de la temperatura, se puede producir la llama; a este tipo de reacciones se les llama reacciones de combustión .
Como vimos anteriormente, la oxidación es la pérdida de electrones experimentada por un elemento o un ión en beneficio de otro que se comporta como agente oxidante. Toda pérdida de electrones de una sustancia va acompañada por la ganancia de electrones de otro. A este último proceso se le conoce, como también ya dijimos, con el nombre de reducción.
La oxidación es el proceso que origina y conduce a la corrosión , tendencia que tienen los metales (y en general todos los materiales de la naturaleza) a recuperar su estado original (situación de mínima energía).
La mayoría de los metales, y el caso particular del hierro (acero), se encuentran en la naturaleza en forma de óxidos, sulfuros y carbonatos: Sulfuro de hierro (piritas), Óxido de hierro (hematites roja / parda, magnetita), Carbonato de hierro (siderita) a partir de los cuales pueden obtenerse mediante la aportación de grandes cantidades de energía. Los metales así obtenidos se encuentran en una situación inestable por lo que progresivamente vuelven a su estado natural.
Lo mismo sucede con el Zinc , metal que no se encuentra en la naturaleza tal y como lo conocemos sino que se presenta en forma de Sulfuro de zinc (blenda), Óxido de zinc (cincita), Carbonato de zinc ( Smithonita)
La diferencia entre el Hierro y el Zinc la encontramos en que cuando este último se oxida, debido al ataque de los agentes atmosféricos, se recubre de una capa blanca muy estable e insoluble de sales de zinc que impide el progreso de la corrosión mientras nada ni nadie la elimine. En cambio en el hierro, la oxidación se produce progresivamente hasta la total destrucción del metal.
Para realizar el proceso de oxidación se pueden utilizar diferentes mecanismos o sistemas, entre ellos podemos mencionar:
|
Oxidación química.
Reacción que tiene lugar, por ejemplo, en presencia del oxígeno disuelto del agua en un proceso a través del cual el oxígeno es reducido y el compuesto orgánico es oxidado. (Utilizado para purificar aguas servidas)
Oxidación electroquímica
La oxidación electroquímica (depuración electroquímica) se produce mediante reacciones anódicas (indirectas y/o directas) en las que el oxígeno es transferido desde el disolvente (agua) a los productos que deben oxidarse.
La característica principal del tratamiento es que utiliza la energía eléctrica como vector de descontaminación ambiental.
Oxidación biológica
Llamamos metabolismo al conjunto de reacciones de un organismo. Estas reacciones son producidas por la acción de los microorganismos.
Fauna microbiana intestinal en la oxidación biológica de los alimentos

|
| Estanque para tratar aguas por oxidación biológica. |
Los microorganismos son sistemas que necesitan una gran cantidad de energía para mantenerse ordenados. Esta energía se obtiene de la oxidación de compuestos orgánicos reducidos. Los nutrientes proporcionan esos compuestos reducidos y, en el curso de la oxidación, se libera energía (que se acumula en forma de moléculas almacenadoras de energía, especialmente el ATP ) y se producen elementos estructurales que servirán para la construcción de nuevas células (crecimiento y diferenciación).
Al proceso por el que se obtiene energía y elementos estructurales básicos a partir de nutrientes se le denomina catabolismo y al que utiliza la energía obtenida en el catabolismo para sintetizar nuevos componentes celulares se le denomina anabolismo . Es importante tener en cuenta que aunque se estudie de forma separada el anabolismo y el catabolismo , ambos tipos de procesos ocurren simultáneamente de forma que conforme se van produciendo elementos estructurales y energía en el catabolismo , esos elementos se usan para formar nuevos componentes celulares en procesos anabólicos.

|
| Planta para oxidación térmica. |
Un ejemplo de este tipo de oxidación es la Oxidación de los ácidos grasos ( metabolismo ).
También se utiliza la oxidación biológica en los procesos de purificación de aguas residuales.
La oxidación biológica consiste en suministrar oxígeno al agua residual en unos tanques cuyo volumen está previamente calculado para mantener el agua durante un tiempo de cuando menos ocho horas, regulando el oxigeno disuelto entre 1 a 3 Mg/Lt.
Oxidación térmica
Método de oxidación que empleando hornos se aplica para incinerar de residuos, los que se transforman en materias inertes (cenizas o escorias) y gases a través de una combustión controlada a temperaturas elevadas (900º C).
Lo que comúnmente llamamos basura, técnicamente se conoce como desechos sólidos y consiste básicamente de todo material, producto de las actividades humanas, que se bota o elimina por carecer de valor o utilidad.

|
| Planta de oxidación catalítica. |
El compostaje es un proceso biológico controlado de descomposición aeróbica acelerada de los materiales orgánicos. Se puede hacer una comparación entre la combustión (oxidación química) y el compostaje (oxidación biológica). En ambos procesos el carbón presente se oxida (química o biológicamente respectivamente) y si la combustión es completa se tienen como productos dióxido de carbono (CO2), agua (pO) y energía en forma de calor.
Es importante señalar que el oxígeno vital puede desplazarse más todavía por otros gases, tales como el dióxido de carbono. Cuando esto sucede, el resultado es a menudo una atmósfera que puede ser peligrosa o fatal cuando se la respira. Las deficiencias de oxígeno también pueden ser ocasionadas por moho, corrosión, fermentación u otros tipos de oxidación que consumen oxígeno. El impacto de las deficiencias de oxígeno puede ser paulatino o repentino.
Oxidación catalítica
Existen unas sustancias, denominadas catalizadores , que tienen la propiedad de acelerar la reacción de oxidación de los compuestos orgánicos volátiles a temperaturas relativamente bajas, generalmente entre 250 y 350º C, sin experimentar un cambio químico.
|
| Respiración: un proceso de oxidación. |
Los gases a depurar deben ser calentados hasta alcanzar la temperatura de funcionamiento del catalizador. Este calor necesario es suministrado por un quemador a gas o un calentador eléctrico. Para reducir el consumo energético, puede instalarse un precalentador que aproveche el calor de los gases ya depurados.
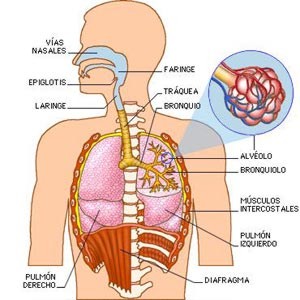
Oxidación y respiración
La oxidación es el efecto primario de la respiración en el cuerpo, es un proceso natural que implica que el oxígeno se combine con otra sustancia. Como resultado de esta oxidación, la composición química de ambas sustancias cambia.
Otro ejemplo lo tenemos con la respiración celular , que no es más que la oxidación de glucosa (C 6 H 12 O 6 ) a CO 2 y la reducción de oxígeno a agua .
La ecuación sumaria para la respiración de la célula es:
C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O
Ya vimos que, técnicamente hablando, la oxidación incluye cualquier reacción en la cual se transfieren electrones, la mayoría de las oxidaciones producen grandes cantidades de energía. La oxidación es como una combustión dentro del cuerpo, cuando el oxígeno convierte los azúcares en energía.
Nuestro cuerpo también usa la oxidación como defensa contra bacterias, virus, fermentaciones, etcétera, porque las moléculas oxidantes atacan a las células patógenas y éstas son expulsadas de cuerpo a través del proceso normal de eliminación.
Ver: Óxido-reducción
Fuente Internet:
http://www.radioformula.com.mx/entreten/rf2101.asp?ID=19645
Ver, además, en Internet:
http://www.tareasya.com/noticia.asp?noticia_id=1965

