Agua |
El agua es un compuesto químico presente en grandes cantidades en la Tierra, en estado liquido, sólido o gaseoso.
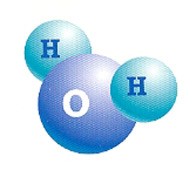
El agua es un compuesto de hidrógeno y oxigeno, su formula química, H 2 O, indica que cada molécula de agua contiene dos átomos de hidrógeno y uno de oxígeno.
El agua, a pesar de ser un líquido incoloro, inodoro e insípido, es en realidad una sustancia química de reacciones esenciales para la vida.
|
A la presión atmosférica (760 mm de mercurio), el punto de congelación del agua es de 0° C y su punto de ebullición de 100° C.
El agua es uno de los agentes ionizantes más conocidos. Puesto que todas las sustancias son de alguna manera solubles en agua, se la conoce frecuentemente como el disolvente universal. El agua combina con ciertas sales para formar hidratos, reacciona con los óxidos de los metales formando ácidos y actúa como catalizador en muchas reacciones químicas importantes. (Ver: Ionización del agua) .
Propiedades bioquímicas
Los seres vivos se han adaptado para utilizar químicamente el agua en dos tipos de reacciones:
• En la fotosíntesis en la que los enzimas utilizan el agua como fuente de átomos de hidrógeno.
• En las reacciones de hidrólisis, en que las enzimas hidrolíticas han explotado la capacidad del agua para romper determinados enlaces hasta degradar los compuestos orgánicos en otros más simples, durante los procesos digestivos.

|
Propiedades físico-químicas
El agua presenta las siguientes propiedades físico-químicas:
• Acción disolvente.
El agua es el líquido que más sustancias disuelve (disolvente universal), esta propiedad se debe a su capacidad para formar puentes de hidrógeno con otras sustancias, ya que estas se disuelven cuando interaccionan con las moléculas polares del agua.
La capacidad disolvente es la responsable de dos funciones importantes para los seres vivos: es el medio en que transcurren la mayoría de las reacciones del metabolismo, y el aporte de nutrientes y la eliminación de desechos se realizan a través de sistemas de transporte acuoso. (Ver: Soluciones (o disoluciones) químicas ).
• Fuerza de cohesión entre sus moléculas.
Los puentes de hidrógeno mantienen a las moléculas fuertemente unidas, formando una estructura compacta que la convierte en un líquido casi incompresible.
• Elevada fuerza de adhesión.
De nuevo los puentes de hidrógeno del agua son los responsables, al establecerse entre estos y otras moléculas polares, y es responsable, junto con la cohesión, de la capilaridad, a la cual se debe, en parte, la ascensión de la sabia bruta desde las raíces hasta las hojas.
• Gran calor específico.

|
El agua absorbe grandes cantidades de calor que utiliza en romper los puentes de hidrógeno. Su temperatura desciende más lentamente que la de otros líquidos a medida que va liberando energía al enfriarse. Esta propiedad permite al citoplasma acuoso servir de protección para las moléculas orgánicas en los cambios bruscos de temperatura.
• Elevado calor de vaporización.
A 20° C se precisan 540 calorías para evaporar un gramo de agua, lo que da idea de la energía necesaria para romper los puentes de hidrógeno establecidos entre las moléculas del agua líquida y, posteriormente, para dotar a estas moléculas de la energía cinética suficiente para abandonar la fase líquida y pasar al estado de vapor.
• Elevada constante dieléctrica.
Por tener moléculas bipolares, el agua es un gran medio disolvente de compuestos iónicos, como las sales minerales, y de compuestos covalentes polares como los glúcidos.
Las moléculas de agua, al ser polares, se disponen alrededor de los grupos polares del soluto, llegando a desdoblar los compuestos iónicos en aniones y cationes, que quedan así rodeados por moléculas de agua. Este fenómeno se llama solvatación iónica.
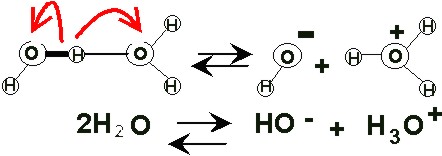
• Bajo grado de ionización.
El agua pura tiene la capacidad de disociarse en iones, por lo que en realidad se puede considerar una mezcla de:
agua molecular (H 2 O )
protones hidratados (H 3 O + ), llamados también iones hidronio o iones hidrógeno, o simplemente H*, e
iones hidroxilo (OH – )
|
De cada 107 moléculas de agua, sólo una se encuentra ionizada.
Esto explica que la concentración de iones hidronio (H+) y de los iones hidroxilo (OH – ) sea muy baja. Dados los bajos niveles de H+ y de OH – , si al agua se le añade un ácido o una base, aunque sea en poca cantidad, estos niveles varían bruscamente. (Ver más sobre Agua: Propiedades y funciones )
|
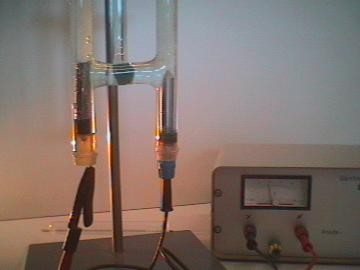
Electrólisis del agua
Al pasar electricidad por agua (H 2 O), se forma gas hidrógeno en el cátodo y oxígeno en el ánodo, como el agua contiene dos átomos de hidrógeno por cada uno de oxígeno, se produce el doble de hidrógeno que oxígeno, se divide así el compuesto en dos partes.
Ver: www2.uni-siegen.de/.../spanish/v21-2.html y Ver, también: Agua oxigenada )
Cuidado del agua
Todo lo que se ha visto, que es la gran importancia que tiene el agua para la vida humana y para la vida en general en el planeta, sirve para comprender lo importante que es cuidarla; no solamente evitando malgastar el agua de que disponemos, sino también evitando que se contamine. (Ver: Hidrósfera )
Si bien es cierto que a escala mundial el agua siempre seguirá existiendo en la misma cantidad, porque el agua es un recurso natural renovable; no es menos cierto que en cada lugar solamente puede obtenerse una cantidad limitada, y, por lo tanto, debe cuidarse.
En Chile, como en casi todo el mundo, estamos acostumbrados a que el agua sea abundante y en general fácilmente accesible; pero no debemos perder de vista que igualmente es una sustancia muy valiosa, que debe utilizarse con prudencia así como evitar su degradación por el exceso de contaminación de las fuentes utilizables. (Ver: Contaminación del agua )
No hay que olvidar que, precisamente por ser un recurso renovable, el agua deberá utilizarse una y otra vez; por lo cual hay que preocuparse de que sea posible disponer de ella en condiciones adecuadas.
Del mismo modo que es vehículo de vida, el agua puede ser el medio por el cual se difundan enfermedades; cuando se le incorporen sustancias malignas para la salud o la vida, como ocurre cuando algunos productos de desecho son echados a las corrientes de agua sin una debida depuración previa.

|
El agua constituye, por sus propiedades, una sustancia sumamente útil para ciertos procesos industriales, al igual que como medio de saneamiento de las ciudades y de limpieza en general.
Para muchos de esos fines, se disuelven en ella productos —como los jabones y detergentes&mdash que operan sobre otras sustancias haciéndolas también solubles en el agua, para separarlas y extraerlas. Pero eso da por resultado aguas que contienen sustancias perjudiciales, que se llaman aguas servidas , de las que es preciso deshacerse.
La disposición de las aguas servidas debe realizarse de tal manera que sea posible evitar que las sustancias perjudiciales que contienen, contaminen las fuentes de aguas puras, de las que es preciso obtener nuevamente agua en condiciones que permitan usarla sin peligro.
Para ello, es preciso que, antes de devolver esas aguas a los cauces de la naturaleza, se le separe esas sustancias perjudiciales; y a la vez ellas sean procesadas en forma de quitarles esa condición. A eso, se le llama la depuración del agua; que significa devolverle su pureza originaria.
Existen diversos métodos para depurar y purificar el agua contaminada por las actividades humanas, antes de devolverla a sus cauces naturales:
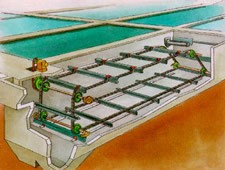
Depuración y tratamiento de las aguas
Por definición, las aguas residuales llevan elementos extraños denominados contaminantes. Por tanto, la depuración del agua consistirá en retirar de una u otra forma dichos contaminantes.
Basándose en las características y propiedades físicas de los contaminantes, se consigue su eliminación total o parcial.
Tratamientos físicos típicos:
|
Sedimentación : Se basa en la separación de los contaminantes sólidos, cuya densidad es mayor que la del líquido, por acción de la gravedad.
Flotación : Se basa en la separación por diferencia de densidad de los contaminantes sólidos cuya densidad es menor que la del líquido. Esta flotación puede ser natural o provocada, como ocurre en el caso de introducción de aire a presión.
Filtración : Se fundamenta en la retención de sólidos provocada por la interposición de un medio poroso. Los sólidos quedan retenidos en la superficie o en el interior del medio poroso. Como medios porosos se utilizan materiales como arenas, carbón activo, vidrio, o membranas sintéticas. La filtración puede realizarse a presión o sin ella.
Destilación : Consiste en evaporar artificialmente el agua de forma que luego sea posible capturar el vapor para volver a condensarlo en forma líquida.
Es un método todavía más costoso, porque requiere utilizar un aparato especial llamado alambique —que puede llegar a alcanzar gran tamaño y complejidad— y disponer de un medio para calentar al agua hasta la temperatura de ebullición y eventualmente de otro sistema para volver a enfriar rápidamente el vapor para que condense. El agua purificada por destilación se llama agua destilada .
Adsorción : Por medio de la fijación (física o química) sobre un sólido el contaminante se retira de una solución. Como medios de adsorción se emplean, entre otros, carbón activo y zeolitas.

|
Desorción (Stripping) : Se provoca un stripping cuando una masa líquida se pone en contacto con una corriente de aire al cual se transfiere el contaminante. Este proceso es típico para la eliminación de amoniaco en aguas industriales con altas concentraciones del mismo.
Tratamientos químicos:
Coagulación-Floculación . Los sólidos de pequeño tamaño, mediante el uso de reactivos químicos, se agregan en sólidos mayores que son sedimentables. Normalmente son tratamientos que van seguidos de algún medio de separación física.
Mediante este tratamiento conseguimos eliminar partículas de tamaño coloidal, con velocidades de sedimentación muy bajas.
Precipitación química . Mediante este tratamiento se consigue, mediante la adición de reactivos, que contaminantes solubles se transformen en formas insolubles o de menor solubilidad.
Oxidación-Reducción química . Consiste en hacer reaccionar los contaminantes con reactivos que provoquen la pérdida de electrones (oxidación) o la ganancia de electrones (reducción) de los contaminantes.

|
|
Precipitación química del agua
|
Reducción electrolítica . Este tratamiento incluye reacciones de oxidación-reducción sobre la superficie de electrodos (generalmente del cátodo). Es un procedimiento de recuperación.
Intercambio iónico . Consiste en poner en contacto un líquido con un sólido que presente facilidad para intercambiar iones. Normalmente estos sólidos son resinas de intercambio iónico.
Ver: Ciclo del agua
Ver: Agua: datos y estadísticas
Fuentes Internet:
http://www.escueladigital.com.uy/ciencnat/agua.htm
Ver:
http://www.bonatura.com/agua.htm
http://www.lenntech.com/espanol/FAQ-quimica-agua.htm
http://www.lenntech.com/espanol/informacion-quimica-avanzada-del-agua.htm
Además, para seguir un curso gratis:
http://www.solomanuales.org/manual_quimica_basica_del_agua-manuall31126015.htm
http://www.solomanuales.org/manuales_quimica_del_agua-manuall214233.htm

