Estructura de las proteínas |
La palabra proteína proviene del griego protop (lo primero, lo principal, lo más importante). La proteínas son las responsables de la formación y reparación de los tejidos, interviniendo en el desarrollo corporal e intelectual.
Las proteínas son biopolímeros (macromoléculas orgánicas), de elevado peso molecular, constituidas básicamente por carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); aunque pueden contener también azufre (S) y fósforo (P) y, en menor proporción, hierro (Fe), cobre (Cu), magnesio (Mg), yodo (Y), entre otros elementos.
Estos elementos químicos se agrupan para formar unidades estructurales (monómeros) llamados aminoácidos ( aa ), a los cuales se consideran como los "ladrillos de los edificios moleculares proteicos". Estos edificios macromoleculares se construyen y desmoronan con gran facilidad dentro de las células, y a ello debe precisamente la materia viva su capacidad de crecimiento, reparación y regulación.
La unión de un bajo número de aminoácidos da lugar a un péptido ; si el número de aa que forma la molécula no es mayor de 10, se denomina oligopéptido ; si es superior a 10, se llama polipéptido y si el número es superior a 50 aa , se habla ya de proteína .
Las proteínas son, en resumen, biopolímeros de aminoácidos y su presencia en los seres vivos es indispensable para el desarrollo de los múltiples procesos vitales. |
Se clasifican, de forma general, en Holoproteínas y Heteroproteínas según estén formadas, respectivamente, sólo por aminoácidos o bien por aminoácidos más otras moléculas o elementos adicionales no aminoacídicos.
La organización de una proteína viene definida por cuatro niveles estructurales denominados: estructura primaria, estructura secundaria, estructura terciaria y estructura cuaternaria . Cada una de estas estructuras informa de la disposición de la anterior en el espacio.
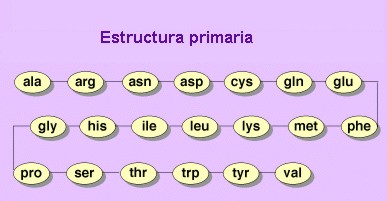
Estructura primaria
|
La estructura primaria es la secuencia de aminoácidos de la proteína. Nos indica qué aminoácidos componen la cadena polipeptídica y el orden en que dichos aminoácidos se encuentran. La función de una proteína depende de su secuencia y de la forma que ésta adopte.
|
Estructura secundaria
La estructura secundaria es la disposición de la secuencia de aminoácidos en el espacio. Los aminoácidos, a medida que van siendo enlazados durante la síntesis de proteínas y gracias a la capacidad de giro de sus enlaces, adquieren una disposición espacial estable, la estructura secundaria .
Existen dos tipos de estructura secundaria:
|
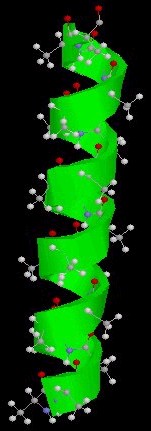
1.- La a(alfa)-hélice Esta estructura se forma al enrollarse helicoidalmente sobre sí misma la estructura primaria. Se debe a la formación de enlaces de hidrógeno entre el -C=O de un aminoácido y el -NH- del cuarto aminoácido que le sigue.
|
|
2.- La conformación beta En esta disposición los aminoácidos no forman una hélice sino una cadena en forma de zigzag, denominada disposición en lámina plegada. Presentan esta estructura secundaria la queratina de la seda o fibroína.
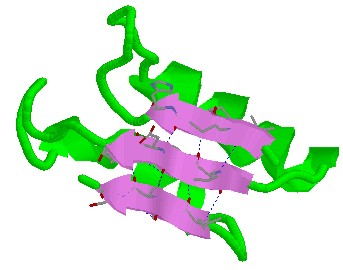
|
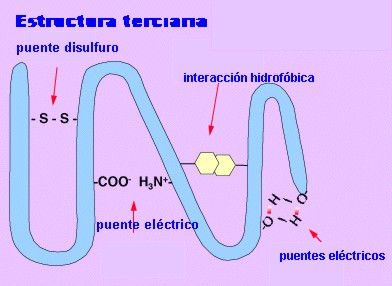
Estructura terciaria
La estructura terciaria informa sobre la disposición de la estructura secundaria de un polipéptido al plegarse sobre sí misma originando una conformación globular.
En definitiva, es la estructura primaria la que determina cuál será la secundaria y por tanto la terciaria.
Esta conformación globular facilita la solubilidad en agua y así realizar funciones de transporte, enzimáticas, hormonales , etc.
|
Esta conformación globular se mantiene estable gracias a la existencia de enlaces entre los radicales R de los aminoácidos. Aparecen varios tipos de enlaces: 1.- el puente disulfuro entre los radicales de aminoácidos que tienen azufre. 2.- los puentes de hidrógeno. 3.- los puentes eléctricos. 4.- las interacciones hidrófobas .
|
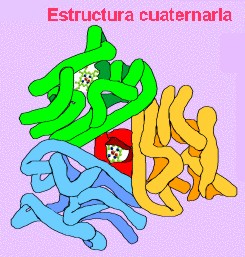
Estructura cuaternaria
|
Esta estructura informa de la unión, mediante enlaces débiles (no covalentes) de varias cadenas polipeptídicas con estructura terciaria, para formar un complejo proteico. Cada una de estas cadenas polipeptídicas recibe el nombre de protómero . El número de protómeros varía desde dos, como en la hexoquinasa; cuatro, como en la hemoglobina , o muchos, como la cápsida del virus de la poliomielitis, que consta de sesenta unidades proteicas.
|
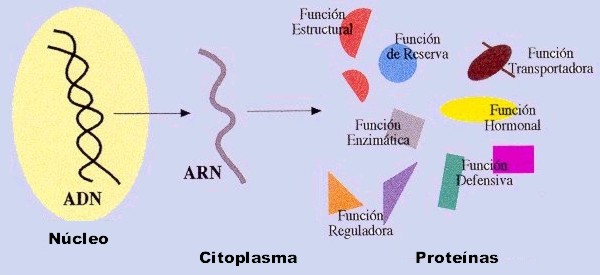
Funciones y ejemplos de proteínas
|
Las proteínas determinan la forma y la estructura de las células y dirigen casi todos los procesos vitales. Las funciones de las proteínas son específicas de cada una de ellas y permiten a las células mantener su integridad, defenderse de agentes externos, reparar daños, controlar y regular funciones, etc...
Todas las proteínas realizan su función de la misma manera: por unión selectiva a moléculas. Las proteínas estructurales se agregan a otras moléculas de la misma proteína para originar una estructura mayor. Sin embargo, otras proteínas se unen a moléculas distintas: los anticuerpos, a los antígenos específicos; la hemoglobina, al oxígeno; las enzimas, a sus sustratos; los reguladores de la expresión genética, al ADN ; las hormonas, a sus receptores específicos; etc...
A continuación se exponen algunos ejemplos de proteínas y las funciones que desempeñan:
Función estructural
|
·
Algunas proteínas
constituyen estructuras celulares.
|
Función enzimática
|
Las proteínas con función enzimática son las más numerosas y especializadas. Actúan como biocatalizadores de las reacciones químicas del metabolismo celular.
Ver: PSU: Biología; Pregunta 04_2006 |
Función hormonal
|
Algunas hormonas son de naturaleza proteica, como la insulina y el glucagón (que regulan los niveles de glucosa en sangre), o las hormonas segregadas por la hipófisis, como la del crecimiento o la adrenocorticotrópica (que regula la síntesis de corticosteroides) o la calcitonina (que regula el metabolismo del calcio).
|
Función reguladora
|
Algunas proteínas regulan la expresión de ciertos genes y otras regulan la división celular (como la ciclina).
|
Función homeostática
| Algunas mantienen el equilibrio osmótico y actúan junto con otros sistemas amortiguadores para mantener constante el pH del medio interno. |
Función defensiva
|
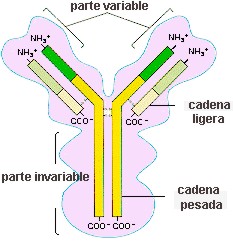
· Las inmunoglobulinas actúan como anticuerpos frente a posibles antígenos. · La trombina y el fibrinógeno contribuyen a la formación de coágulos sanguíneos para evitar hemorragias. · Las mucinas tienen efecto germicida y protegen a las mucosas. · Algunas toxinas bacterianas, como la del botulismo, o venenos de serpientes, son proteínas fabricadas con funciones defensivas.
|
Función de transporte
|
·
La
hemoglobina transporta oxígeno en la sangre de los vertebrados.
·
La hemocianina transporta
oxígeno en la sangre de los invertebrados.
·
La mioglobina transporta
oxígeno en los músculos.
·
Las lipoproteínas
transportan lípidos por la sangre.
· Los citocromos transportan electrones.
|
Función contráctil
|
· La actina y la miosina constituyen las miofibrillas responsables de la contracción muscular. · La dineina está relacionada con el movimiento de cilios y flagelos. |
Función de reserva
|
· La ovoalbúmina de la clara de huevo, la gliadina del grano de trigo y la hordeína de la cebada, constituyen la reserva de aminoácidos para el desarrollo del embrión. · La lactoalbúmina de la leche. |
| Ir a: Historia de las proteínas y aminoácidos | Volver a: Alimentos y nutrientes |
Fuente Internet:
http://www.um.es/~molecula/prot.htm