Masa atómica, masa molecular y unidad de masa atómica |
Masa es la cantidad de materia de un elemento.
Todos los aspectos cuantitativos de la química descansan en conocer las masas de los compuestos estudiados.
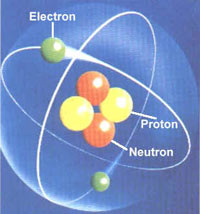
Conceptualmente, masa atómica (m. a.) es la masa de un átomo, y la masa de un átomo en particular es la suma de las masas de sus protones y neutrones, y varía en los distintos isótopos.
|
| Masa atómica: protones más neutrones. |
Sabemos que los átomos de elementos distintos tienen distinta masa entre sí. Por ejemplo, un átomo de hidrógeno tiene distinta masa que un átomo de cobre. El átomo de cobre tiene más masa; por lo tanto, pesa más que el átomo de hidrógeno (tiene mayor peso atómico).
Los átomos son tan pequeños que no podemos medir (pesar) la masa de un átomo individualmente. No existe una balanza capaz de medir la masa de un solo átomo.
Tampoco es posible contar los átomos necesarios para ajustar una deterrminada combinación o reacción química entre elementos distintos.
Pero lo que sí sabemos es que existe el concepto de mol , el cual representa un número definido de átomos.
Un mol se define como la cantidad de materia que tiene tantas unidades como el número de átomos que hay en exactamente 12 gramos de 12 C.
Se ha demostrado que este número es: 6,0221367 x 10 23
Se abrevia como 6,02 x 10 23 , y se conoce como número de Avogadro .

|
| Un mol de producto se puede pesar. |
El mol permite “contar” (conocer su número) entidades químicas de forma indirecta cuando son pesadas. Esta medición se puede hacer porque los átomos de un determinado elemento siempre tienen la misma masa.
Para su comprensión, diremos que tal como el término “docena” hace referencia a una cantidad de doce elementos cualesquiera pero iguales entre sí, el mol representa el número 6,02 x 10 23 .
(Repasar el tema Notación científica ) .
Tal como es fácil colegir que la masa de una docena de huevos (12 huevos) es distinta a la masa de una docena de ladrillos (12 ladrillos), también la masa de un mol de hidrógeno (6,02 x 10 23 átomos de hidrógeno) es distinta a la masa de un mol de cobre (6,02 x 10 23 átomos de cobre).
Como ya lo dijimos más arriba, los distintos elementos tienen distinta masa, y el valor de cada una de sus masas ya ha sido cuantificado (tiene un valor). El valor de la masa de cada elemento nos lo entrega la conocida Tabla Periódica .
En la Tabla Periódica suele representarse el símbolo, el nombre, el número atómico y la masa atómica relativa (o peso atómico) de los elementos como datos básicos y, según su complejidad, algunos otros datos sobre los elementos.
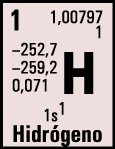
|
| Masa atómica: 1,00797. |
Atención, esto es lo más relevante:
Cuando en la Tabla Periódica se indica un valor para la masa atómica , hay que entender que se trata de la masa atómica relativa de los elementos, ya que ese valor de masa se obtiene al comparar la masa de cada elemento con una unidad de referencia (el valor de la masa atómica está en relación a una unidad definida).
Ojo, recalquemos que también se dice peso atómico para referirse a la masa atómica relativa .
Pero, volviendo al punto, ¿Cuál es la unidad de referencia?
Unidad de masa atómica
Se la llama u.m.a. , que quiere decir Unidad de Masa Atómica, aunque también puede encontrarse por su acrónimo inglés "a.m.u." (Atomic Mass Unit). Esta unidad también es llamada Dalton , en honor al químico con ese apellido, y simbolizada como Da . Esta última nomenclatura (Da) es la elegida por el Sistema Internacional de Magnitudes ; sin embargo, el símbolo recomendado es simplemente " u ".
Pero, ¿cuál es el valor de la u.m.a. ?

|
| Masa atómica: 63,54. |
Por acuerdo científico, se ha definido que su valor es igual a la 1/12 (doceava) parte de la masa del isótopo 12 del átomo de Carbono y su valor se corresponde aproximadamente con la masa de un protón (o un átomo) de hidrógeno.
Entonces, cuando se muestra un valor (un número) como masa atómica (o peso atómico) de un elemento, ese número está indicando cuántas veces la masa de un átomo de ese elemento es mayor que la unidad de masa atómica. (Recuerden, por eso es masa atómica relativa, pues se relaciona con una unidad, la u. m. a.
Para aclarar la idea de relativa , debemos tomar en cuenta que para cualquier medición que realizamos diariamente siempre consideramos una unidad de referencia.
Por ejemplo: cuando medimos el largo de una calle nuestra unidad de referencia es el metro.
Ya que mencionamos la Tabla Periódica, ¿qué leemos en ella cuando nos indica que la masa atómica del Cu = 63,54?
Debemos entender que nos dice que la masa de un átomo de Cu es 63,54 veces mayor que la u.m a., pero no que la masa de un átomo de Cu es 63,54 g
En el caso del hidrógeno, indica masa atómica del H = 1,00797, debemos leer que la masa de un átomo de H es 1,00797 veces mayor que la u.m.a., pero no que la masa de un átomo de H es 1,00797 g.
Anteriormente dijimos que no existe una balanza capaz de medir la masa de un solo átomo.
Pero sí ha sido posible medir (pesar) la masa de una gran cantidad de átomos y resulta que 6,02 x 10 23 u. m. a. pesan un gramo masa; o sea, un mol de u.m.a. pesa un gramo .

|
| Masa atómica: 4,0026. |
Ahora, la gran pregunta ¿Cuánto pesará un mol de cobre?
Con los antecedentes que ya tenemos, es muy fácil:
La masa atómica relativa (o peso atómico) del cobre es 63,54 veces mayor que la u.m a., por lo tanto, un mol de cobre pesa 63,54 gramos.
Y para entrar en calor, otra pregunta ¿cuántos moles de cobre hay en 120 gramos del metal?
Fácil: si un mol de cobre pesa 63,54 gramos, hago
![]()
63,54 g = 1 mol en el caso del cobre; pero esta correspondencia la podemos aplicar a cualquier elemento:
El peso atómico (masa atómica relativa) de cualquier elemento nos señala que ése es el peso en gramos (masa) de un mol de átomos (6,02 x 10 23 átomos) del elemento.
Por ejemplo, la Tabla Periódica nos muestra que el helioo tiene un peso atómico de 4,0026. Por consiguiente, un mol de átomos de helio pesa 4,0026 gramos/mol.
También es posible trabajar con fracciones (o múltiplos) de los moles:
|
Ejemplos de la Relación Mol/Peso Usando el Helio |
||
|
Mol del Helio |
Átomos del Helio |
Gramos del Helio |
|
1/4 |
1,505 x 10 23 |
1 g |
|
1/2 |
3,01 x 10 23 |
2 g |
|
1 |
6,02 x 10 23 |
4 g |
|
2 |
1,204 x 10 24 |
8 g |
|
10 |
6,02 x 10 24 |
40 g |
|
Para recordar: El peso atómico (masa atómica relativa) de todos los elementos está indicado en la tabla periódica. Para cada elemento ese valor corresponde, además, al peso en gramos de un mol del mismo (6,02 x 10 23 átomos del elemento). |
|
| El peso atómico (masa atómica relativa) de un elemento identifica la masa de un mol de átomos de ese elemento (en gramos/mol). |
Una acotación:
Recordemos que, con excepción del hidrógeno, el núcleo de todo átomo está formado por cantidades iguales de protones y de neutrones que pesan más o menos lo mismo; por lo tanto, un mol de átomos (6,02 x 10 23 átomos) está constituido por un mol de protones (6,02 x 10 23 protones) y un mol de neutrones (6,02 x 10 23 neutrones) y cada uno de estos moles equivale al cincuenta por ciento (la mitad) del peso átómico (masa atómica relativa) del elemento.
Veamos esto con un ejemplo:
Tomemos el hidrógeno. Un mol de hidrógeno (6,02 x 10 23 ) pesará 1,01 gramos.
|
|
|
Un Átomo de Hidrógeno
|
Un átomo de hidrógeno está formado por un protón (sin neutrón) rodeado por un electrón, pero el electrón (como cualquier electrón) pesa tan poco que casi no incide en el peso de un átomo.
Entonces, si dejamos de lado el peso de los electrones de hidrógeno, diremos que un mol de protones (H núcleo) pesa aproximadamente un gramo.
Pero en el caso de cualquier otro elemento, como el helio que ya mencionamos, en un mol de helio hay dos moles de protones (dos gramos) y dos moles de neutrones (dos gramos), que suman cuatro gramos de partículas (la masa atómica del helio es 4,00; o sea, un mol de helio pesa 4 gramos).
Masa molecular (o peso molecular)
Hasta aquí hemos hablado solo de masa de átomos, y de sus componentes: protones y neutrones. Ahora hablarenos de masa de moléculas (que son combinaciones de diferentes átomos).
Previamente recordemos que las moléculas, como entidad, también se cuantifican en mol, y un mol de moléculas es igual a 6,02 x 10 23 moléculas.
Sabemos que no se puede pesar la masa de una molécula individualmente.
Entonces, ¿cómo calculamos la masa molecular de una sustancia?
Sumando las masas atómicas relativas de los elementos que componen dicha sustancia.
Para aclarar el conncepto:
Si una persona sube con otra sobre una balanza, ésta registra el peso combinado de ambas personas. Cuando los átomos forman moléculas, los átomos se unen y el peso de la molécula es el peso combinado de todas sus partes.
Por ejemplo, cada molécula de agua (H 2 O) tiene dos átomos de hidrógeno y un átomo de oxígeno. Un mol de moléculas de agua contiene dos moles de átomos de hidrógeno y un mol de átomos de oxígeno.
|
Relación del Mol y el Peso del Agua y de sus Partes |
|||||||||||||||
|
Según esto, una botella llenada con exactamente 18,02 g de agua debería contener 6,02 x 10 23 moléculas de agua.
El concepto de las fracciones y de los múltiplos tambíen se aplica a las moléculas. De esta manera, 9,01 g de agua debería contener 1/2 mol, o 3,01 x 10 23 moléculas de agua.
Como vemos, se puede calcular el peso molecular (masa molecular) de cualquier compuesto simplemente sumando el peso de los átomos (masa atómica relativa) que conforman el compuesto.
Otro ejemplo:
Calcular la masa molecular (m. m.) del óxido de aluminio, cuya fórmula es Al 2 O 3 ; o sea, 2 átomos de Aluminio y 3 átomos de Oxígeno.
|
m.m. Al 2 O 3 = |
2 x m.a. Aluminio |
+ |
3 x m.a. Oxígeno |
|
m.m. Al 2 O 3 = |
2 x 27 |
+ |
3 x 16 |
|
m.m. Al 2 O 3 = |
54 |
+ |
48 |
|
m.m. Al 2 O 3 = |
102 |
|
|
Con propiedad podemos decir que Masa molecular relativa (obtenida por la suma de las masas de sus átomos) es un número que indica cuántas veces es mayor la masa de una molécula que la unidad de masa atómica, y dicho número o valor nos indica el peso en gramos (masa molecular) de un mol de moléculas.
Interconversión entre masas, moles y número de partículas
Es necesario rastrear las unidades en los cálculos de interconversión de masas a moles.
A esto lo conocemos formalmente con el nombre de análisis dimensional .
Ejemplo:
Calcular la masa de 1,5 moles de cloruro de calcio
Fórmula química del cloruro de calcio = CaCl 2
Masa atómica del Ca = 40,078 u.m.a.
Masa atómica del Cl = 35,453 u.m.a.
Al ser un compuesto iónico no tiene peso molecular, sino peso fórmula..
Peso fórmula del CaCl 2 = (40,078) + 2(35,453) = 110,984 u.m.a.
De manera que, un mol de CaCl 2 tendrá una masa de 110,984 gramos. Y entonces, 1,5 moles de CaCl 2 pesarán:
(1,5 mol)(110,984 gramos/mol) = 166,476 gramos
Ejemplo:
Si tuviera 2,8 gramos de oro, ¿cuántos átomos de oro tendría?
Fórmula del oro: Au
Peso fórmula del Au = 196,9665 u.m.a.
Por lo tanto, 1 mol de oro pesa 196,9665 gramos.
De manera que, en 2,8 gramos de oro habrá:
(2,8 gramos)(1 mol/196,9665 gramos) = 0,0142 mol
Sabemos por medio del número de Avogadro que hay aproximadamente 6,02 x 1023 atomos/mol.
Por lo cual, en 0,0142 moles tendremos:
(0,0142 moles)(6,02x10 23 atomos/moles) = 8,56x10 21 átomos
Fuentes Internet:
http://www.fortunecity.com/campus/dawson/196/masaatomica.htm
http://es.scribd.com/doc/56044/MASA-ATOMICA
http://www.visionlearning.com/library/module_viewer.php?mid=53&l=s
http://www.lenntech.es/periodica/masa/masa-atomica.htm
http://www.eis.uva.es/~qgintro/esteq/tutorial-01.html
http://www.eis.uva.es/~qgintro/esteq/esteq.html