Metales alcalinos |
Los metales alcalinos corresponden al Grupo 1 de la Tabla Periódica (anteriormente grupo I A).
Estos metales son: Litio (Li) , sodio (Na) , potasio (K) , rubidio (Rb) , cesio (Cs) y francio (Fr) .
Constituyen el 4,8 por ciento de la corteza terrestre, incluyendo capa acuosa y atmósfera. El sodio y el potasio son los más abundantes; el resto es raro.
|
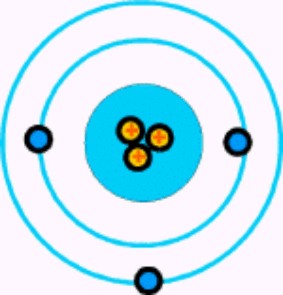
| Átomo de litio. |
El nombre de esta familia proviene de la palabra árabe álcalis , que significa cenizas ; ya que los primeros compuestos de sodio y potasio fueron descubiertos en cenizas de maderas.
También, al reaccionar con agua, estos metales forman hidróxidos, que son compuestos que antes se llamaban álcalis.
Son metales blandos, tan es así que el sodio se puede cortar fácilmente con un cuchillo. Al cortarlos o fundirlos se observa su color plateado y su brillo metálico.
Los metales alcalinos son de baja densidad. Li, Na y K son menos densos que el agua. El Li es el más duro y a la vez el menos denso. El Cs es el más blando y el más denso.
Son blanco-plateados, con puntos de fusión bajos (debido a las fuerzas de enlace débiles que unen sus átomos) que decrecen según se desciende en el grupo y blandos, siendo el litio el más duro. Sus puntos de fusión bajos están comprendidos entre 181º C para el Li y 28,7º C para el Cs.
Estos metales son los más reactivos químicamente. Por ejemplo: el sodio reacciona enérgicamente con el agua, mientras flota, desprendiéndose gases de hidrógeno. El potasio reacciona aún más violentamente que el sodio.
|
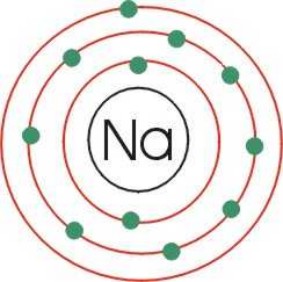
| Átomo de sodio. |
Por estos motivos, esta clase de metales no se encuentran en estado libre en la naturaleza, sino en forma de compuestos, generalmente sales.
Los elementos sodio y potasio son componentes fundamentales de los seres vivos. Se encuentran en forma de iones, cuyas propiedades son muy diferentes a la de los metales.
El NaCl (cloruro de sodio) es el soluto más abundante en el agua del mar. El KNO3 (nitrato de potasio) es el salitre, y abunda en algunos yacimientos, especialmente en Chile.
Grandes depósitos naturales de compuestos de litio se encuentran en el fondo de lagos que se secaron.
El rubidio y el cesio son muy escasos. El francio es altamente radiactivo y de muy corta vida (22 minutos), por lo que es mucho más escaso aún.
Su configuración electrónica muestra un electrón en su capa de valencia (1 electrón s).
Son muy electropositivos: baja energía de ionización. Por tanto, pierden este electrón fácilmente (número de oxidación +1) y se unen mediante enlace iónico con otros elementos.
En estado sólido forman redes cúbicas.
Como el resto de los metales, los metales alcalinos son maleables, dúctiles y buenos conductores del calor y la electricidad.
Presentan efecto fotoeléctrico con radiación de baja energía, siendo más fácil de ionizar el cesio. La reactividad aumenta hacia abajo, siendo el cesio y el francio los más reactivos del grupo.
El litio se parece bastante más al magnesio en cuanto a reactividad que al resto de los alcalinos, debido a que el ion Li+ es muy pequeño.
Los metales alcalinos se recubren rápidamente de una capa de hidróxido en contacto con el aire y reaccionan violentamente en contacto con el agua, liberando hidrógeno que, debido al calor desprendido, arde (con rubidio y cesio la reacción es explosiva, ya que al ser más densos que el agua, la reacción la producen en el fondo y el hidrógeno formado arde produciendo una onda de choque que puede romper el recipiente).
También reaccionan con el vapor de agua del aire o con la humedad de la piel. Deben guardarse en líquidos apolares anhidros.
Líquidos apolares son aquellos cuyas moléculas no presentan polarización, siendo de este modo hidrófugos (no se mezclan con el agua). Apolares son, por ejemplo, el aceite, el metano.

|
| Lepidolita, una de las mayores fuentes del raro rubidio y del cesio. |
Son reductores poderosos, sus óxidos son básicos así como sus hidróxidos. Reaccionan directamente con los halógenos, el hidrógeno, el azufre y el fósforo originando los haluros, hidruros, sulfuros y fosfuros correspondientes.
Con el amoníaco líquido dan soluciones de color azul en las que hay electrones libres ocupando cavidades formadas por moléculas de amoníaco; estas soluciones se emplean para reducir compuestos orgánicos. Según aumenta la concentración de metal, la solución toma color bronce y empieza a conducir la electricidad.
Casi todas las sales son solubles en agua, siendo menos solubles las de litio.
Se emplean como refrigerantes líquidos en centrales nucleares (litio, sodio, potasio) y como conductores de corriente dentro de un revestimiento plástico.
Sus compuestos tienen un gran número de aplicaciones.
Fuentes Internet:
http://www.liceodigital.com/tercero/quimica3/m_alcali.htm
http://www.adi.uam.es/docencia/elementos/spv21/sinmarcos/elementos/familias.html#gn
www.lenntech.com/espanol/tabla-peiodica/Na.htm
Ver imágenes en:
www.vi.cl/foro/index.php?showtopic=7597
Ver, además, videos ilustrativos (audio en inglés) en:
http://www.taringa.net/post.php?id=949608

