Equilibrio químico |
Cuando estudiamos los cambios en la materia aprendimos que todo cambio químico involucra una reacción entre diferentes sustancias produciendo la formación de sustancias nuevas.
Podemos decir, entonces, que una reacción química es un proceso en que una o más sustancias se transforman en otra u otras sustancias de diferente naturaleza.
Las sustancias originales (las que se transformarán) se denominan reactantes o reactivos y las finales se llaman productos .

|
| Un cambio químico siempre es una reacción. |
Todos los procesos químicos evolucionan desde los reactantes hasta la formación de productos a una determinada velocidad hasta que la reacción se completa. En ese momento, la velocidad de formación de los productos es igual a la velocidad de descomposición de éstos para formar nuevamente los reactantes de los que proceden.
Desde ese mismo momento las concentraciones de todas las especies reaccionantes (reactantes y productos) permanecen constantes. Ese estado se conoce con el nombre de equilibrio químico .
El equilibrio químico es un estado en el que no se observan cambios visibles en el sistema. Sin embargo, a nivel molecular existe una gran actividad debido a que las moléculas de reactantes siguen produciendo moléculas de productos, y estas a su vez siguen formando moléculas de productos.
Como ya dijimos, cuando se alcanza el equilibrio químico las velocidades de la reacción directa (
![]() ) e inversa (
) e inversa (
![]() ) son iguales y las concentraciones de los reactantes y de los productos permanecen constantes. Para que esto ocurra, la reacción debe suceder a una
temperatura
y
presión
constantes en un recipiente cerrado en el que ninguna sustancia pueda entrar o salir.
) son iguales y las concentraciones de los reactantes y de los productos permanecen constantes. Para que esto ocurra, la reacción debe suceder a una
temperatura
y
presión
constantes en un recipiente cerrado en el que ninguna sustancia pueda entrar o salir.
Es importante diferenciar entre el equilibrio en términos de velocidad, en el que ambas velocidades son iguales, del equilibrio en términos de concentraciones, donde éstas pueden ser, y normalmente son, distintas.
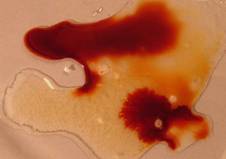
|
| Los cambios en la coloración grafican el avance hacia el equilibrio químico cuando reaccionan estas dos sustancias. |
Factores que modifican el equilibrio
Existen diversos factores capaces de modificar el estado de equilibrio en un proceso químico, como son: la temperatura , la presión (afectando al volumen ) y las concentraciones .
La influencia de estos tres factores se puede predecir, de una manera cualitativa por el Principio de Le Chatelier, que dice lo siguiente:
Si en una reacción química en equilibrio se modifican la presión, la temperatura o la concentración de alguna de las especies reaccionantes, la reacción evolucionará en uno u otro sentido hasta alcanzar un nuevo estado de equilibrio.
Este principio es equivalente al principio de la conservación de la energía .

|
| Más temperatura rompe el equilibrio de una reacción. |
Efecto de la temperatura
Es la única variable que, además de influir en el equilibrio, modifica el valor de su constante.
Si una vez alcanzado el equilibrio se aumenta la temperatura, el sistema se opone a ese aumento de energía calorífica desplazándose en el sentido que absorba calor; es decir, hacia el sentido que marca la reacción endotérmica.
Aquí debemos recordar que en las reacciones químicas existen dos tipos de variación con la temperatura:
Exotérmica : aquella que libera o desprende calor.
Endotérmica : aquella que absorbe el calor.
Es importante hacer notar que a bajas temperaturas, la reacción requiere más tiempo, debido a que bajas temperaturas reducen la movilidad de las partículas involucradas. Para contrarrestar este efecto se utiliza un catalizador para acelerar la reacción.
Respecto a los catalizadores, se ha determinado que estos no tienen ningún efecto sobre la concentración de los reaccionantes y de los productos en equilibrio. Esto se debe a que si un catalizador acelera la reacción directa también hace lo mismo con la reacción inversa, de modo que si ambas reacciones se aceleran en la misma proporción, no se produce ninguna alteración del equilibrio.
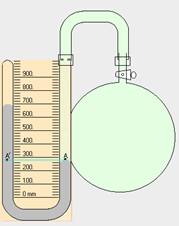
|
| Aumentar o disminuir la presión también rompe el equilibrio químico. |
Efecto de la presión
Si aumenta la presión la reacción se desplazará hacia donde exista menor número de moles gaseosos, para así contrarrestar el efecto de disminución de volumen, y viceversa.
Lógicamente, en el caso de que las cantidades de moles gaseosos sean iguales para cada lado de la ecuación, no se producirán cambios, es decir que el equilibro no se desplazará. También se puede aumentar la presión del sistema sin afectar el equilibrio agregando un gas noble.
Efecto de las concentraciones
Un aumento en la concentración de uno de los reactivos hace que el equilibrio se desplace hacia la formación de productos, y a la inversa en el caso de que se disminuya dicha concentración. Y un aumento en la concentración de los productos hace que el equilibrio se desplace hacia la formación de reactivos, y viceversa en el caso de que se disminuya.
Ver: PSU: Química; Pregunta 09_2005Quimica2
Ver: Reacción química
Ver: Estequiometría
Fuentes Internet:
http://es.answers.yahoo.com/question/index?qid=20071209165508AAZFwQl
http://www.mcgraw-hill.es/bcv/guide/capitulo/8448157133.pdf
http://www.netcom.es/pilar_mu/equilibrio.htm
http://es.wikipedia.org/wiki/Principio_de_Le_Ch%C3%A2telier
http://www.rena.edu.ve/cuartaEtapa/quimica/Tema5.html
http://www.uv.es/baeza/equili.html

